






Ключевыми ориентирами в нынешней научной деятельности являются термодинамика и кинетика химических реакций. Данные науки осуществляют помощь научному сообществу теоретическими объяснениями пролить свет на скорость и эффективность течения реакций. Соответственно главенствующей гипотезе «соударения», вышеуказанные свойства находятся в прямой зависимости от сосредоточенности рефлектирующих элементов и кинетической энергии хаотического перемещения молекул.

Рисунок 1. Термодинамика и кинетика фазовых переходов в НДС.
Но относительно большая скорость и эффективность большого количества химических реакций встречается и при существенно малых сосредоточениях и сниженных температурных показателях. В данной ситуации все явление оснащается в обязательном порядке присутствием в среде реакции катализатора. Катализатор – это устройство, ускоряющее воздействие частиц, однако не является ключевой частью результирующего изделия.
В то же время, плотная, а часто и беспорядочная взаимосвязь реагирующих частиц с катализаторами не постоянно обладает химической природой. Эффективность этих явлений в живых организмах сдержана значительно низкими температурными показателями, которые помогают осуществить взаимосвязь системы малыми сосредоточениями существующих элементов. Это осуществляет помощь сберечь белковый состав. Каждая клеточная реакция в данном моменте будут считаться каталитическими.
Основой устойчивого инструментария работы большинства белковых частиц представляется совпадение пространственной системы реагирующих объектов и его собственного пространства в соответствии с особенностями «ключа» либо «замочной скважины». Зачастую, все ферменты являются довольно специфичными, таким образом, предоставляют возможность обеспечения максимально две однородные реакции. Каждая химическая реакция в термодинамике подразделяется на два вида:
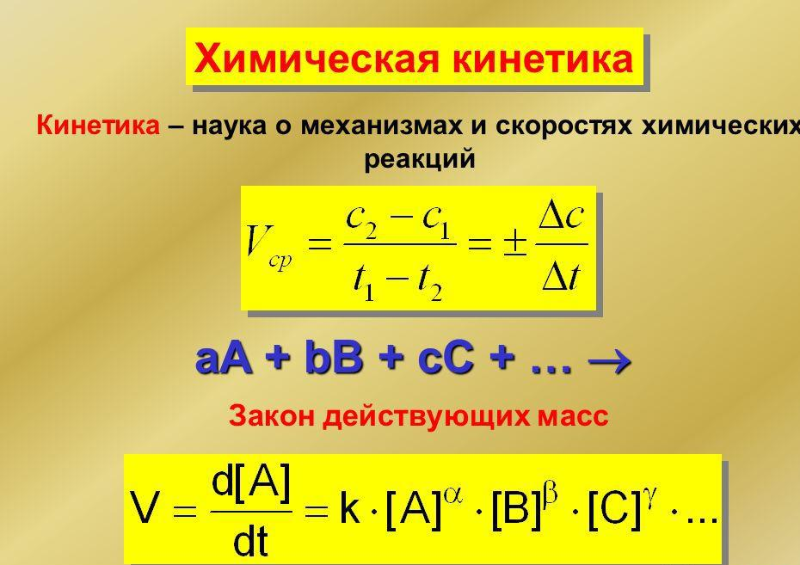
Рисунок 2. Химическая кинетика.
Взаимный обмет внутренней энергией меж системой, которая активна, и окружающей средой четко и вразумительно формулируют термодинамические начала. Применение положений и постулатов термодинамики в химическом направлении предоставляет возможность ученым разрешать важнейшие проблемы о фундаментальной вероятности разных химических явлений, определенных условий их возникновения, в том числе установить уровень преобразования реагирующих элементов в процессах, а также проанализировать их последующую энергетику.
Термодинамические начала анализируются относительно системы, поглощающей энергию химических веществ. Энергия, которая получается системой, отмечается знаком плюс, в свою очередь, отданная энергия отмечается знаком минус. Изменяемые показатели, определяющие состояние системы, именуются параметрами состояния. Более частое применение в термодинамической системе отслеживается у следующих параметров:
Не нашли то, что искали?
Попробуйте обратиться за помощью к преподавателям
Положение системы, а также преобразования, которые в ней происходят можно классифицировать благодаря ключевым функциям состояния. Данные функции непосредственно зависят от свойств химического вещества, а также, от перехода исследуемого объекта из одного состояния в иное. К ним исследователи причисляют:
Большое количество химических опытов производится в открытых емкостях, т.е. при стабильном давлении атмосферы. Химическая кинетика изучает и представляет основные свойства физических явлений, таких как скорость планируемой реакции и непосредственная зависимость определенной реакции от наружных воздействий. Для практичности расчетных действий скорость химических явлений устанавливают по преобразованию сосредоточенности существующих веществ за определенный промежуток времени.
Для достоверного установления скорости реакции предостаточно установить степень концентрирования в пространстве исключительно одного их принимающих участие в системе элементов. К тому же, полностью не имеет значения какого элемента – то ли первоначального, то ли конечного. В термохимических уравнениях все тепловые явления реакций фиксируются из расчета на один моль первоначального либо конечного вещества. По данной причине существует определенная вероятность присутствия дробных коэффициентов.
При химических явлениях появляется диалектический закон борьбы противоположностей и единства системы.
На первый взгляд, каждая система направляется к урегулированию и нормализации – снижение переменной Н, а в ином случае происходит стремление к хаосу и беспорядочности. Первое стремление невольно повышается со снижением температурных показателей, а второе стремление с методичным увеличением температуры. Стремление к хаотическому перемещению обуславливает химическая величина, которая именуется энтропией. Она обозначается литерой S, и измеряется в Дж/К (Джоуль/Кельвин).
Сложно разобраться самому?
Попробуйте обратиться за помощью к преподавателям
Дифференциальное уравнение, которое описывает биологическую (химическую) кинетику выглядит следующим образом:
\(dC_i / dt = f_i (C_1, …, C_n),\)
где \(C_i\) – переменная, которая характеризует i-ый компонент системы. Это может быть концентрация веществ, количество клеток, численность вида.
\(dC_i / dt\) – скорость изменения этой переменной во времени.
\(f_i (C_1, …, C_n)\) – функция, которая зависит от компонентов системы.
Основой для явлений обмена клетки с окружением и для внутреннего метаболизма является относительно многообразная сеть созданных определенным образом в пространстве и времени различных реакций. В результате воздействия данных явлений полностью преобразовываются концентрации веществ, которые активны, число определенных клеток, биологическая масса живых объектов. В том числе, могут преобразовываться и иные значения, такие как трансмембранный потенциал в клетке.
Преобразования вышеуказанных переменных значений во времени и являются базой кинетики биологических процессов. Следовательно, кинетика изучает обоснованности и правомерности течения биохимических явлений во времени, их механизмы вероятных преобразований, которые зависят от различных факторов (концентрации реагирующих веществ, температурных показателей, давления, Ph-среды и т.д.).
Все гомогенные элементарные реакции, которые сегодня существуют, отличают по количеству активных молекул, принимающих участие в изначальном акте химического взаимного воздействия. По данному характеру химической реакции общепринято разделять бимолекулярные, мономолекулярные и тримолекулярные реакции.
Скорость реакции и эффективность нулевой последовательности все время стабильна во времени, а также не находится в зависимости от воздействия реагирующих веществ. Данное условие типично для гетерогенных устройств, в той ситуации, если всеобщая скорость диффузии химических реагентов меньше скорости их преобразования к поверхности раздела фаз.
Формируя удовлетворяющий требованиям состав конкретных физических требований, источников катализаторов и тепловой энергии, можно достичь того, что раствор простейших компонентов вызовет создание важнейшего изделия благодаря цепочке бесконтрольных людям реакций с появлением интервальных соединений.
Следовательно, в нестабильных условиях ультрафиолета электрических химических разрядов, из раствора аммиака, водорода, окиси углерода, метана, углекислого газа, и минимальных количеств кислорода, исследователи сумели воспроизвести произвольный синтез сахаров, аминокислот и азотистых основ. Что подтверждает вероятность появления сложнейших органических формирований из простейших химических веществ благодаря произвольному эволюционному процессу в химии.
Закажите подходящий материал на нашем сервисе. Разместите задание – система его автоматически разошлет в течение 59 секунд. Выберите подходящего эксперта, и он избавит вас от хлопот с учёбой.
Гарантия низких цен
Все работы выполняются без посредников, поэтому цены вас приятно удивят.
Доработки и консультации включены в стоимость
В рамках задания они бесплатны и выполняются в оговоренные сроки.
Вернем деньги за невыполненное задание
Если эксперт не справился – гарантируем 100% возврат средств.
Тех.поддержка 7 дней в неделю
Наши менеджеры работают в выходные и праздники, чтобы оперативно отвечать на ваши вопросы.
Тысячи проверенных экспертов
Мы отбираем только надёжных исполнителей – профессионалов в своей области. Все они имеют высшее образование с оценками в дипломе «хорошо» и «отлично».
Эксперт получил деньги, а работу не выполнил?
Только не у нас!
Безопасная сделка
Деньги хранятся на вашем балансе во время работы над заданием и гарантийного срока
Гарантия возврата денег
В случае, если что-то пойдет не так, мы гарантируем возврат полной уплаченой суммы
















































Заполните форму и узнайте цену на индивидуальную работу!




