






Всякая определенная система, которая находится в конкретных внешних условиях, в некоторое время перемещается в новое, равновесное термодинамическое состояние. Данное исследовательское высказывание возможно понимать, как одно из ключевых положений статистической физики.
Свойства идеального газа описываются уравнением Менделеева-Клапейрона: \(pV = nRT,\) где p, V, T являются параметрами состояния газа. Формула, которая их связывает, является уравнением состояния. Уравнением Менделеева-Клапейрона не учитывает собственный объем молекул газа и межмолекулярное взаимодействие. В идеальном газе столкновения молекул между собой и со стенками сосуда абсолютно упругие.

Реальные газы при высоких давлениях занимают больший объем, чем занимал бы идеальный газ в аналогичных условиях. Реальные газы описываются уравнением состояния идеального газа только приближенно, и отклонения от идеального поведения становятся заметными при высоких давлениях и низких температурных показателях, особенно когда газ близок к конденсации. Наглядная характеристика отклонения реальных газов от идеального поведения оказывается мольный объем \(Vm = V/n\)
В представление ключевых внешних условий входит задание состояния координат внешних относительно к системе объектов, которые определяют элементы и их силы. Данные параметры внешних объектов именуются внешними показателями идеального газа. В ситуации изотропной равномерной системы взамен параметров координат, внутри которых находятся все перемещающиеся частицы, в роли внешнего значения зачастую применяется исключительно объем системы.
В некоторых ситуациях, если внешние материальные объекты организовывают продолжительные поля (электрические, магнитные и гравитационные) в роли значений избираются непосредственно напряженности полей.
К примеру, давление на материальный объект, зависящее от температурных показателей и энергетического объема без наличия внешних полей. К количеству внутренних показателей исследователи приписывают степень диссоциации молекулярного газа, которая зависит от его плотности и объема.
Говоря иными словами, внутренние факторы идеальных газов в полной мере являются самостоятельными и не находятся в зависимости от внешних показателей. В равновесном термодинамическом и прямолинейном состоянии системы, ее значения обладают, при верно установленных параметрах, определенными числовыми величинами.
Сложно разобраться самому?
Попробуйте обратиться за помощью к преподавателям
К данным условиям возможно отнести:
Когда реальные газы находятся в помещении, где комнатные температурные показатели и нормальное атмосферное давление, они будут вести себя аналогично идеальным газам. Данными компонентами системы могут быть водород и гелий, характеристики которых уже при обыкновенных условиях соответствуют всем законам идеального газа.

Параметры давления P, объема V и температурные показатели T, описывающие состояние газа, именуются параметрами макроскопического состояния, естественно взаимосвязанные друг с другом. По данной причине, увеличение или уменьшение одного параметра приводит к преобразованию других параметров.
Зависимость, которая дает взаимную связь между ключевыми характеристиками физического объекта, именуются в термодинамике уравнением состояния. Таким образом, данная зависимость представляется в роли ключевой формулы состояния идеального газа. Ключевыми явлениями в термодинамике идеальных газов, важнейшими отношениями на практике и в теории, считаются:
Методики изучения материальных явлений, которые не зависят от их свойств, осуществляют важнейшую роль, производя вычисления работы преобразования общего объема газа и определяют величину предполагаемой теплоты, подведенной к компоненту в явлении. В том числе, благодаря термодинамическим методикам можно определить присутствие внутреннего энергетического потенциала системы и изменить энтропию системы.
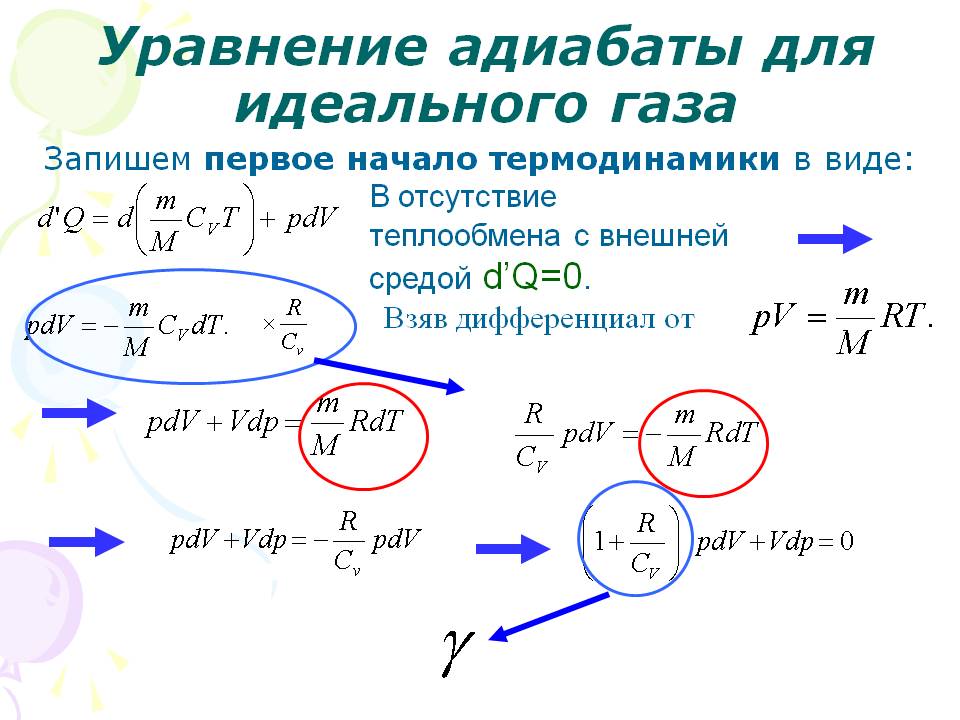
К ключевым калорическим показателям состояния рассматриваемого материального объекта возможно отнести такие термодинамические свойства:
Во время тщательного изучения вышеуказанных явлений можно установить формулу системы в координатах и взаимосвязь между ключевыми показателями состояния идеального газа, измерение внутренней энергии, и в том числе фактическое значение внешней работы и число поглощенной теплоты.

Теплоемкость объекта характеризуется количеством теплоты, которая необходима для нагревания данного объекта на один градус.
\(C = {dQ \over dT}\)
Удельная теплоемкость (Суд) является количеством теплоты, которое необходимо для нагрева единицы веса вещества на один градус. Измерения экспериментальным путем тепловой емкости идеальных газов при обыкновенных наружных условиях фактически идеальным образом сочетаются с иными положениями традиционной термодинамики. Но, целиком традиционная гипотеза тепловой емкости этих веществ не может являться в полной мере удовлетворительной и отвечающей для каждой системы.
Не нашли то, что искали?
Попробуйте обратиться за помощью к преподавателям
Присутствует большое количество разнообразных примеров существенных противоречий между экспериментальными опытами и теоретическими положениями. Это предопределяется тем, что фактическая теория не в состоянии полностью учитывать энергетический потенциал, напрямую взаимосвязанный с внутренним перемещением непосредственно в молекуле.
Гипотезу о равномерном и прямолинейном распределении теплового энергетического потенциала по уровням свободы можно использовать и к перемещению элементов в твердом объекте. Атомы, входящие в состав кристаллической решетки, осуществляют конкретные колебательные процессы возле равновесного положения. Энергия данных вибрационных процессов является внутренней силой материального объекта.
Однако, при нулевых температурных показателях моментально проявляются существенные противоречия между перемещающимися элементами. Есть смысл заметить, что «количество теплоты» и «теплоемкость» являются не совсем удачными терминами. Данные термины выпали на долю нынешней науке в наследие от старых принципов теории теплорода, господствовавших в XVIII веке.
Данная гипотеза исследовала теплоту и энергетический потенциал идеальных газов как универсальное невесомое вещество, которое содержится во всех материальных объектах. Было принято, что данные показатели нет возможности ни создать, ни уничтожить. Нагрев физических объектов трактовался повышением, а охлаждение трактовалось снижением количества, находящегося внутри них теплорода.
Но теория теплорода оказалась полностью несостоятельной. Данная теория не обладает возможностью описания, по какой причине подобные преобразования внутреннего энергетического потенциала объекта можно получить, передавая ему совершенно различное число теплоты в зависимости от осуществляемой системой работы. По данной причине, утрачен физический смысл непосредственного высказывания, что в материальном объекте находится конкретный резерв теплоты.
Закажите подходящий материал на нашем сервисе. Разместите задание – система его автоматически разошлет в течение 59 секунд. Выберите подходящего эксперта, и он избавит вас от хлопот с учёбой.
Гарантия низких цен
Все работы выполняются без посредников, поэтому цены вас приятно удивят.
Доработки и консультации включены в стоимость
В рамках задания они бесплатны и выполняются в оговоренные сроки.
Вернем деньги за невыполненное задание
Если эксперт не справился – гарантируем 100% возврат средств.
Тех.поддержка 7 дней в неделю
Наши менеджеры работают в выходные и праздники, чтобы оперативно отвечать на ваши вопросы.
Тысячи проверенных экспертов
Мы отбираем только надёжных исполнителей – профессионалов в своей области. Все они имеют высшее образование с оценками в дипломе «хорошо» и «отлично».
Эксперт получил деньги, а работу не выполнил?
Только не у нас!
Безопасная сделка
Деньги хранятся на вашем балансе во время работы над заданием и гарантийного срока
Гарантия возврата денег
В случае, если что-то пойдет не так, мы гарантируем возврат полной уплаченой суммы
















































Заполните форму и узнайте цену на индивидуальную работу!




