






Термодинамика растворения состоит в том, что этот процесс является самопроизвольным:
\(∆G<0 ; ∆G=∆H-T∆S.\)
Если твердое вещество растворяется в жидком, то:
\(∆S>0; ∆H_{раст.}=∆H_{кр.реш.}+∆H_{сольв.}+∆H_{диф.}\)
В итоге при внезапном проникновении одного соединения в другое преобразуется структура вещества, и изменяются его свойства.
Процесс растворения в термодинамике рассматривается как множество явлений физической и химической природы. При этом выделяют три разновидности такого процесса:
Суммарно энтальпия вышеперечисленных процессов рассчитывается по следующей формуле:
\(DH=DH_1+DH_2+DH_3\)
Сложно разобраться самому?
Попробуйте обратиться за помощью к преподавателям
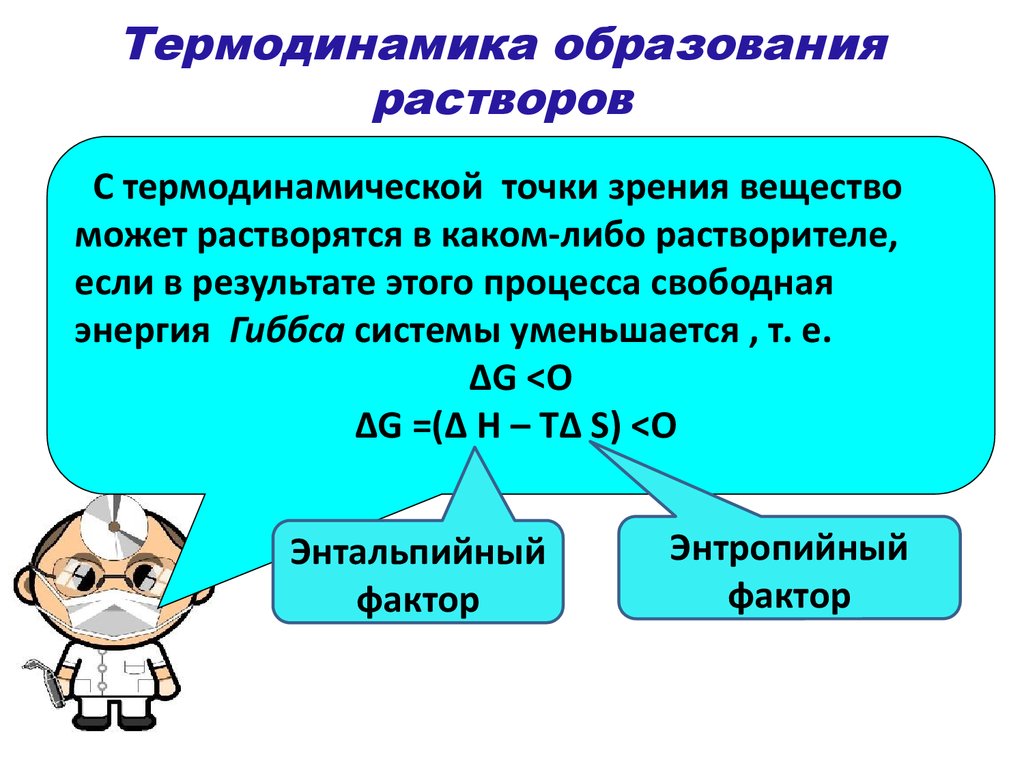
Термодинамика растворения состоит в том, что при этом свободная энергия Гиббса системы снижается:
\(∆G<0; ∆G=(∆H-T∆S)<0,\)
где ∆H – фактор энтальпии
T∆S – фактор энтропии.
Процесс растворения в термодинамическом учении рассматривается как самопроизвольный процесс.
Данное равновесие может нарушить изменение одного из параметров – давления, температуры или добавление дополнительных соединений.
Растворимость приравнивается к итоговой концентрации вещества в насыщенном растворе. Небольшие кристаллические соединения при растворении поглощают внутреннюю энергию (DH>0 – энергия, которая идет на уничтожение химических взаимосвязей элементов), при этом увеличивается энтропия (DS>0 – число частиц увеличивается). Таким образом, по формуле Гиббса \(∆G=∆H-T∆S\) для самопроизвольного протекания процесса растворения твердых тел в воде необходимо повышение температуры. При этом с повышением температуры растворимость многих веществ снижается.
Для глубоких водоемов данный эффект имеет особое значение. Поскольку теплая вода имеет меньшую плотность, чем холодная, она не перемешивается и находится в верхних слоях водоема. Данное явление не дает кислороду проникать в более глубокие слои водоема, что пагубно сказывается на жизнедеятельности его глубинных обитателей.
При повышении давления растворимость газообразных веществ в воде увеличивается. Как например, при производстве газировки. А вот что касается растворимости жидкости в жидкости, на этот процесс не влияет изменение давления, а только смена температуры.
Не нашли то, что искали?
Попробуйте обратиться за помощью к преподавателям
Основным фактором, влияющим на процесс растворения, есть само вещество, его свойства и природа. Еще алхимиками была установлена закономерность, которая гласит, что подобное растворяется в подобном, при этом достигается максимальный эффект.
Присутствие при растворении дополнительных соединений тоже оказывает влияние на растворимость, поскольку снижает первоначальную концентрацию растворителя. Данное явление объясняет «эффект высаливания», когда в насыщенном растворе появляется осадок, если к нему добавляют дополнительное вещество.
Рассмотрим влияние энтропии на растворение. Когда твердые соединения растворяются в жидких, наблюдается процесс перехода соединений в менее стабильное состояние, что сопровождается ростом энтропии концентрации.
Таким образом, энтропия ускоряет растворение, особенно при увеличении температуры. Поэтому можно наблюдать ускорение процесса растворения при повышении температуры веществ. Когда идеальный газ растворяется в жидкости, его состояние становится более упорядоченным, то есть снижается энтропия системы. Таким образом, идеальный газ лучше растворяется в жидкости при понижении температуры, при этом наблюдаем явление экзотермии.

На растворимость соединений влияет ряд факторов, одним из которых есть природа самого соединения, которая зависит от типа химических связей его атомов. В полярных растворителях лучше растворяются соединения с полярными ковалентными и ионными гетерополярными типами связей, а в неполярных растворителях – соединения с неполярными связями.
Растворение одного соединения в другом происходит самопроизвольно, данный процесс длится до достижения термодинамической системой равновесия, когда ∆G=0. В равновесном состоянии образуется насыщенный раствор. Численно растворимость соединения определяется количеством грамм заданного вещества, которое при определенной температуре растворяется в 100 граммах растворителя и образует насыщенный раствор.
Раствор, который пребывает в термодинамическом равновесии с присутствием избытка растворенного вещества, называют насыщенным.
На показатель растворимости влияют следующие факторы:
Поскольку в атомах органических белков присутствует значительное число гидрофильных групп, они очень хорошо растворяются в воде. В термодинамике растворы имеют широкое практическое применение. Например, обыденный прием пищи сопровождается растворением и транспортировкой полезных веществ при помощи растворов. В физике растворами принято считать все физиологические жидкости, а именно кровь и лимфу. Современное производство во многих отраслях основано на применении различных растворов и химических явлений.
Закажите подходящий материал на нашем сервисе. Разместите задание – система его автоматически разошлет в течение 59 секунд. Выберите подходящего эксперта, и он избавит вас от хлопот с учёбой.
Гарантия низких цен
Все работы выполняются без посредников, поэтому цены вас приятно удивят.
Доработки и консультации включены в стоимость
В рамках задания они бесплатны и выполняются в оговоренные сроки.
Вернем деньги за невыполненное задание
Если эксперт не справился – гарантируем 100% возврат средств.
Тех.поддержка 7 дней в неделю
Наши менеджеры работают в выходные и праздники, чтобы оперативно отвечать на ваши вопросы.
Тысячи проверенных экспертов
Мы отбираем только надёжных исполнителей – профессионалов в своей области. Все они имеют высшее образование с оценками в дипломе «хорошо» и «отлично».
Эксперт получил деньги, а работу не выполнил?
Только не у нас!
Безопасная сделка
Деньги хранятся на вашем балансе во время работы над заданием и гарантийного срока
Гарантия возврата денег
В случае, если что-то пойдет не так, мы гарантируем возврат полной уплаченой суммы
















































Заполните форму и узнайте цену на индивидуальную работу!




