






Во время исследований в лабораториях в области химии традиционно интенсивно используются термодинамические расчеты химических реакций. Данные расчеты являются довольно существенными посреди подсчета всех результатов химического экспериментального опыта. Для осуществления термодинамических расчетов требуется использование некоторого количества методик, позволяющих создать фундаментальные выводы об основополагающей вероятности исполнения той либо другой химической реакции, и преобразования в практически эффективный новейший элемент.

Рисунок 1. Закономерности течения химических реакций.
Аналогичные просчеты в термодинамике предоставляют возможность:
Изначально система располагается в некотором предварительно подготовительном состоянии. Далее, после выполнения спланированных намерений, система преобразовывается в окончательное состояние. Данное состояние для системы становиться существенно обновленным, для чего создавались все условия в виде подготовительных просчетов планируемой химической реакции. Аналогичное преобразование традиционно именуют реакцией. И данные реакции могут осуществляться при термодинамических явлениях. При этом само явление именуется физическим преобразованием.
Не нашли то, что искали?
Попробуйте обратиться за помощью к преподавателям
Любые преобразования возможны при сопровождении различных энергетических модификаций. Зачастую происходит выделение либо поглощение теплоты. Термодинамическая система постоянно располагается в состоянии равновесия, если на нее не влияют постоянно разные факторы окружающей среды. В данный момент возможна фиксация незначительных колебательных изменений вблизи координаты равновесия системы, в том числе течение прямых и обратных химические реакции.

Рисунок 2. Энтропия химической реакции.
Присутствует некоторое количество ключевых термодинамических свойств:
При энтальпии течение возможно сопровождение химической реакции преобразованием энергии системы. В это же время невозможно определить точно абсолютную величину энергии. Данное разногласие появляется, если нет возможности привести систему в состояние полного отсутствия энергии. Установлению подлежит исключительно преобразование энергии, достигаемое в процессе осуществления химической реакции. С этой целью возможно осуществить отсчет с любого состояния системы. В данной ситуации осуществляется присвоение на условном уровне величины энергии. Зачастую при установлении применяют нулевое значение. В большинстве случаев, энергия полной термодинамической системы состоит из некоторого количества компонентов, включая, кинетическую энергию перемещения и потенциальную энергию. В случае с кинетической энергией применяются параметры энергии целиком. А потенциальная энергия зависит от положения системы в конкретном наружном поле при внутренней энергии.
Сложно разобраться самому?
Попробуйте обратиться за помощью к преподавателям
Термодинамика химических процессов исследует различные спокойные системы при неимении наружного поля полностью. В данной ситуации, полная энергия приравнивается внутренней энергии. Тепло обращается на форсирование разных преград, препятствующих преобразованию состояния термодинамической системы. Следовательно, осуществляется некоторая работа. Естественно, что полновесные химические преобразования зачастую осуществляются при стабильном объеме.
При энтропии классифицируется ориентир всего химического явления. Энтропию устанавливают, как беспрерывную окончательную функцию состояния системы элементарным итогом. Энтропия устанавливается изначальным и окончательным состоянием исследуемой системы, и не обладает непосредственной зависимостью от следования агрегатного преобразования вещества. При энтропии явления могут разделяться на отрицательные, данные явления именуют также не самопроизвольными, а также положительные, именуемые самопроизвольными.
Ориентир явления устанавливается по знаку преобразования энтропии. От знака направления происходит значительная зависимость в подсчетах. Таким образом, расширение газообразных веществ либо их постепенное перемешивание осуществляется без дополнительных энергетических расходов. Этим обрисовываются самопроизвольные либо отрицательные явления. Аналогичная ситуация возникает при снижении давления
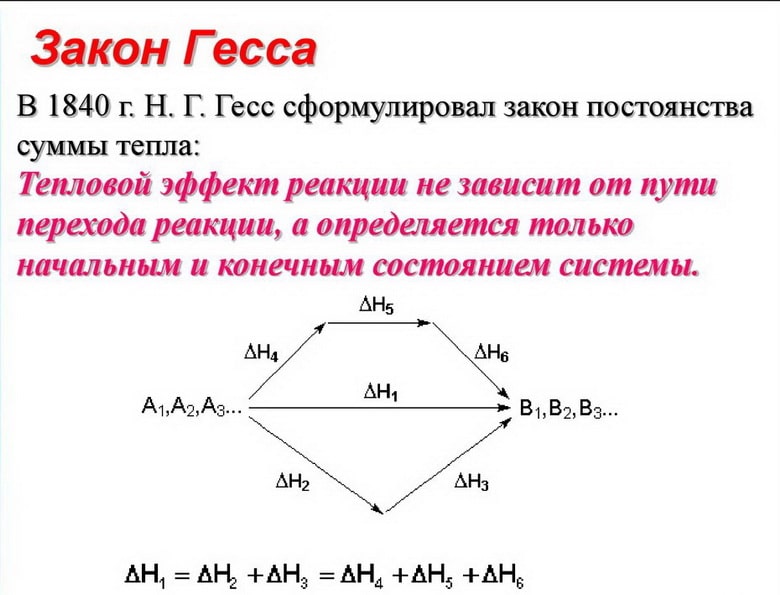
Рисунок 3. Закон Гесса.
При изменении энтальпии реакции возникает связь к системе, характеризующейся первоначальным и окончательным состоянием полной системы. Таким образом, озвучивается закон Гесса. Из данного фундаментального положения в термодинамике возникают такие принципы:
При выполнении экспериментов все требования обязаны отвечать некоторым положенным единым стандартным нормативам, для достижения необходимого достижения. Термодинамические расчеты допускают, что каждый продукт располагается в нормальных условиях начала и окончания экспериментального опыта. Стойкое термодинамическое состояние устанавливается стабильным давлением 0,986923 Бар (100`000 Паскаль) и температурным показателем в 298 K (24,85°C).
Полагается некоторое количество ключевых выводов из закона Гесса. Энтальпия химической реакции сохраняется приравненной сумме энтальпий образования продуктов реакции. В то же время требуется производить вычитание сумму энтальпий изначальных веществ. Во втором результате энтальпия образования вещества будет одинаковой, но различаться в обратную сторону по знаку энтальпии его разложения.
Свободная энергия Гиббса, либо потенциал Гиббса является значение, преобразование которого в процессе химической реакции приравнивается преобразованию внутренней энергии системы. Свободная энергия Гиббса отражает, какая часть от всей внутренней энергии системы возможна для использования при химических реакциях, либо получаема по итогу в указанных условиях. А также, предоставляет возможность установления течения химической реакции в указанных условиях. Математически это термодинамический потенциал выглядит таким образом:
\(G = U + PV - TS\)
Свободная энергия Гиббса возможно воспринимать, как общую потенциальную химическую энергию системы.
Закажите подходящий материал на нашем сервисе. Разместите задание – система его автоматически разошлет в течение 59 секунд. Выберите подходящего эксперта, и он избавит вас от хлопот с учёбой.
Гарантия низких цен
Все работы выполняются без посредников, поэтому цены вас приятно удивят.
Доработки и консультации включены в стоимость
В рамках задания они бесплатны и выполняются в оговоренные сроки.
Вернем деньги за невыполненное задание
Если эксперт не справился – гарантируем 100% возврат средств.
Тех.поддержка 7 дней в неделю
Наши менеджеры работают в выходные и праздники, чтобы оперативно отвечать на ваши вопросы.
Тысячи проверенных экспертов
Мы отбираем только надёжных исполнителей – профессионалов в своей области. Все они имеют высшее образование с оценками в дипломе «хорошо» и «отлично».
Эксперт получил деньги, а работу не выполнил?
Только не у нас!
Безопасная сделка
Деньги хранятся на вашем балансе во время работы над заданием и гарантийного срока
Гарантия возврата денег
В случае, если что-то пойдет не так, мы гарантируем возврат полной уплаченой суммы
















































Заполните форму и узнайте цену на индивидуальную работу!




