






Формирование научного познания о теплоте возникло одновременно с появлением прибора, который способен производить измерения температурных показателей – термометр. Считается, что первые термометры создал известный итальянский физик, механик, астроном, философ, математик Галилео Галилей в конце XVI столетия. Галилео Галилей оказал существенное влияние на науку своего времени.
Термодинамика появилась как эмпирическая научная деятельность о ключевых методах изменения внутренней энергии объектов для осуществления механической работы. В постулатах науки продолжительный промежуток времени оказывался слабо исследованным вопрос о взаимодействиях части и целого.

Рисунок 1. Нулевой закон термодинамики.
Из традиционной термодинамики следует, что замкнутые системы соответственно второму закону термодинамики, подходят для необратимых явлений. Энтропия системы растет до того момента, пока не приобретет максимального значения в абсолютном равновесном состоянии. Возрастание данного фактора сочетается с существенной утратой информации о данной системе. После открытия первого термодинамического начала появился вопрос, каким образом возможно увязать быстрое возрастание энтропии в изолированных системах с процессами самостоятельной организации в неживой и живой природе.
Длительный промежуток времени ученые думали, что есть значительное несоответствие меж заключением второго термодинамического начала и заключениями эволюционной гипотезы Дарвина, в соответствии с которой в каждом организме на Земле осуществляется процесс самоорганизации с помощью принципа селекции. Как результат данного формирования нелинейной термодинамики возникла новая наука.
Ключевыми критериями в вышеуказанной системе считаются:
Противоречия меж термодинамическими началами и примерами развитого мира решилось с возникновением нулевого закона термодинамики, а также со следующим формированием неравновесной нелинейной термодинамики. Неравновесную нелинейную термодинамику также именуют в науке термодинамикой открытых стабильных систем.
Огромную лепту в появление и формирование донного направления науки вложили немецкий физик-теоретик, основатель синергетики Герман Хакен, бельгийский физик и физикохимик российского происхождения Илья Романович Пригожин, а также П. Гленсдорф. Илья Пригожин за труды в данной области был удостоен Нобелевской премии в 1977 году.
Нулевое начало термодинамики определено в 1931 году английским физиком теоретиком, астрофизиком и математиком Ральфом Говардом Фаулером: система, которая находится в равновесном состоянии, обладает стабильными одинаковыми температурными показателями во всех частях системы. И, наоборот, когда температурные показатели во всех частях системы одинаковы, тогда система находится в равновесном состоянии.
Следовательно, вне зависимости от первоначального состояния замкнутой системы, в ней, в конечном итоге, сложится термодинамическое равновесие. Как и иные законы термодинамики, нулевое начало считается итогом выводов экспериментов, и находится в основании метода определения температурных показателей системы благодаря термометрам разного вида.
Нулевое начало термодинамики является логическим описанием объяснения температурных показателей материальных объектов. Температурные показатели считаются важнейшим термодинамическим понятием. Непосредственно температура играет важнейшую роль в системах термодинамики, на ровне с процессами термодинамики.
Нулевое начало термодинамики приняло данное наименование, поскольку оно было сформулировано уже после того, как первые два начала вступили в разряд полностью сложившихся положений. В соответствии с нулевым началом термодинамики, каждая замкнутая система в определенное время сама осуществляет переход в равновесное термодинамическое состояние, и после остается в нем до тем пор, пока наружные факторы не воздействуют на нее.
Нулевое начало ещё именуют всеобщим началом, которое предполагает присутствие стабильного равновесного состояния в системах механического, теплового и химического образования. В том числе, традиционные принципы термодинамики высказываются исключительно о присутствии абсолютного равновесного состояния, однако о сроке его достижения не упоминают.
Потребность и существенность начал термодинамики напрямую взаимосвязана с тем, что данный подраздел физики тщательно производит описание макроскопических параметров систем без определенных соображений в отношении их всеобщего микроскопического обустройства. Проблемами внутреннего обустройства ведает статическая научная деятельность.
Первое начало термодинамики: теплота, которая сообщатся системе, израсходуется на преобразование ее внутренней энергии и на осуществление ею работы против наружных сил. Первый закон термодинамики для элементарного процесса: \({\delta}Q = dU +{\delta}A\)
либо для конечного процесса: \(Q ={ \Delta}U +A\)
Первое начало термодинамики: теплота, которая сообщатся системе, израсходуется на преобразование ее внутренней энергии и на осуществление ею работы против наружных сил. Первый закон термодинамики для элементарного процесса: 
Рисунок 2. Термодинамика.
Для обозначения систем термодинамики в нулевом начале требуется исследовать две системы, которые разделены меж собой теплопроводной стенкой. Данные системы располагаются в постоянной тепловой взаимосвязи. В соответствии с присутствием абсолютного равновесного состояния, со временем происходит момент, когда обе структуры окажутся в данном состоянии достаточно долго. При внезапном разрыве тепловой взаимосвязи, и изолировании перемещающихся компонентов, то их состояние окажется предыдущим.
Любая третья система, которая не изменяет своего расположения при тепловом контакте, не изменит расположение, даже при продолжительной взаимосвязи. Это обозначает, что в термодинамической науке присутствует всеобщая для всех трех систем специфика, сопоставляемая не какому-то определенному явлению, а непосредственно термодинамическому равновесному состоянию.
Сложно разобраться самому?
Попробуйте обратиться за помощью к преподавателям
Данное свойство принято именовать температурой, числовую величину которой устанавливают по величине действующего механического показателя, в форме объема конкретной системы. Данный критерий в этой ситуации возможно именовать термометром. Наиболее обширно принципы нулевого термодинамического начала возможно воспринимать, как представление о присутствии в окружающей среде объектов, к которым используема непосредственно термодинамическая научная деятельность.
Нулевое начало термодинамики говорит, что соответственная система не является очень малой либо довольно большой – количество элементов, формирующих ее, отвечает порядку параметров Авогадро. В действительности параметры незначительных систем постоянно зависимы от существенных колебаний.
Очень большие системы, либо осуществляют переход в состояние равновесия за огромные промежутки времени, или совсем не обладают состоянием равновесия. Из действительности присутствия систем термодинамики появляется положение, которое является основным для последующего исследования.
В нынешней научной деятельности в нулевое начало термодинамики часто осуществляют включение положений о характеристиках теплового постоянного равновесного состояния. Данное значение может пребывать меж существующими системами, разделенными постоянной теплопроводной стенкой, которая позволяет компонентам производить обмен внутренней энергией, однако разрешающей пропуск другого вещества.
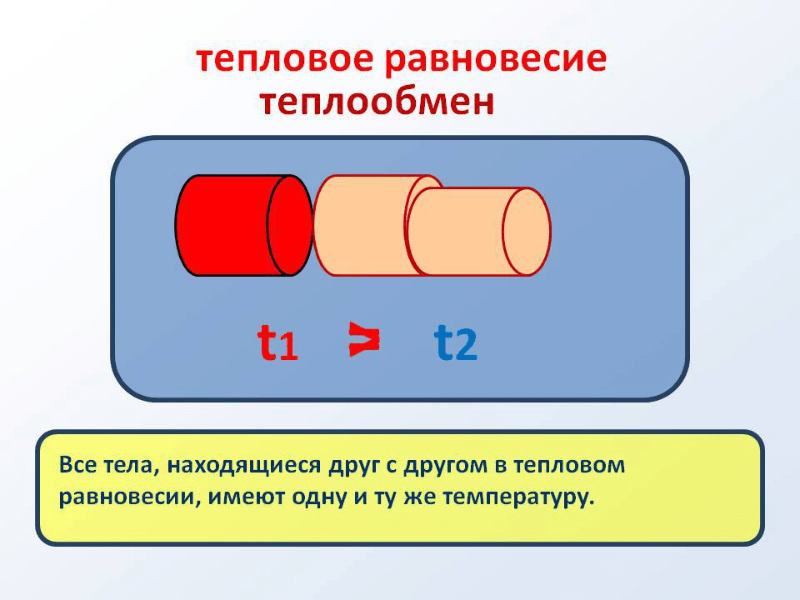
Рисунок 3. Тепловое равновесие.
Иными словами, когда две изолированные системы в нулевом термодинамическом начале ввести в тепловую взаимосвязь, тогда наступления постоянного равновесного состояния все действующие компоненты расположатся в тепловом равновесном состоянии друг с другом. В то же время любая из систем самостоятельно расположится в подобном состоянии.
Не нашли то, что искали?
Попробуйте обратиться за помощью к преподавателям
В зарубежных трудах по термодинамике зачастую нулевым началом термодинамики именуют сам закон о транзитивности теплового равновесия, где ключевые постулаты о приобретении абсолютного равновесного состояния именуются «минусами первых начал». Значительность положения о транзитивности содержится в том, что данное положение предоставляет возможность физикам включить определенную функцию состояния системы, которая обладает важнейшими характеристиками эмпирических температурных показателей. Это осуществляет помощь в разработке устройств для измерения температурных показателей. Равенство определенных параметров, которые измерены благодаря данному прибору – термометру, является основным условием теплового равновесного состояния системы.
Закажите подходящий материал на нашем сервисе. Разместите задание – система его автоматически разошлет в течение 59 секунд. Выберите подходящего эксперта, и он избавит вас от хлопот с учёбой.
Гарантия низких цен
Все работы выполняются без посредников, поэтому цены вас приятно удивят.
Доработки и консультации включены в стоимость
В рамках задания они бесплатны и выполняются в оговоренные сроки.
Вернем деньги за невыполненное задание
Если эксперт не справился – гарантируем 100% возврат средств.
Тех.поддержка 7 дней в неделю
Наши менеджеры работают в выходные и праздники, чтобы оперативно отвечать на ваши вопросы.
Тысячи проверенных экспертов
Мы отбираем только надёжных исполнителей – профессионалов в своей области. Все они имеют высшее образование с оценками в дипломе «хорошо» и «отлично».
Эксперт получил деньги, а работу не выполнил?
Только не у нас!
Безопасная сделка
Деньги хранятся на вашем балансе во время работы над заданием и гарантийного срока
Гарантия возврата денег
В случае, если что-то пойдет не так, мы гарантируем возврат полной уплаченой суммы
















































Заполните форму и узнайте цену на индивидуальную работу!




