






 Рисунок 1. Абсолютное давление в термодинамике.
Рисунок 1. Абсолютное давление в термодинамике.
В термодинамике принято следовать понятию, что все тепловые процессы в объектах квалифицируются исключительно макро показателями:
Данные параметры нет возможности использовать для определенных атомов либо молекул. По данное причине, в термодинамике структура молекул в тепловых явлениях не принимается во внимание, в отличие от молекулярно-кинетической гипотезы. Параметр давления в термодинамике принято обозначать литерой «P». Данные показатель определяет элементарную работу, которая совершается некоторой структурой при замедленном преобразовании ее объема V, порождаемом беспорядочным передвижением внешних объектов. При деформировании упругих тел сила, которая влияет на данную площадь, не является перпендикулярной к данной площади.
При ритмичном и всеобъемлющем сжатии объекта исключительно нормальные напряжения не будут равны нулю, равные изначальному давлению. В статистической физике давление возможно определить, как умножение усреднённого значения энергии E по объему при воздействии постоянной энтропии S, либо как производная от свободной внутренней энергии F по объему при постоянных температурных показателях T. Таким образом, зависимость P от T и V устанавливается формулой состояния. В равновесии и стабильности периодически допускаются метастабильные состояния с P.
Для перехода внутренней энергии объекта в механическую работу, более уместно и рационально применить поршень в цилиндре, который перемещается под давлением газа, наполняющего цилиндр.
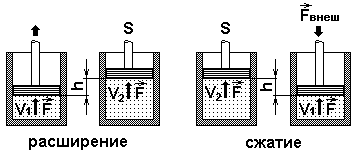
Рисунок 2. Применение поршня в цилиндре.
Внутреннее давление физического объекта возможно преобразовать, выполним над данным объектом некоторую механическую работу. В случае, когда работа осуществляется над веществом, тогда давление непроизвольно преобразуется во внутреннюю энергию. А в случае выполнения работы непосредственно объектом, внутреннее давление объекта устанавливается механическим. Вплоть до окончания XIX века физики были уверены, что в мире присутствует невесомое вещество – теплород, передающее теплоту от одного объекта к иному.
Считалось, что ежели больше вливается теплорода в объект, объект становиться более теплым, и в обратном порядке. Но в 1798 году англо-американский ученый и изобретатель, авантюрист, государственный и общественный деятель Бенджамин Томпсон, граф Румфорд постарался оспорить эту теорию. Основанием этому стали непостоянные нагревы стволов пушек во время высверливания. Ученый допустил, что итогом нагрева и преобразования давления считается механическая работа, наблюдаемая в процессе трения сверла о пушечный металл. Бенджамин Томпсон осуществил научный эксперимент.
Сложно разобраться самому?
Попробуйте обратиться за помощью к преподавателям
Для тщательного изучения данного явления, Бенджамин Томпсон осуществил эксперимент по высверливанию канала в цилиндре, который выточен из металла. В просверленный канал вставлялось затупленное сверло, которое было тщательно прижато к стенкам цилиндра. Далее осуществлялось вращение сверла. В течение получаса сверления температурные показатели возросли до 70°F. При повторении эксперимента с погружением цилиндра со сверлом в емкость с водой, вода за два с половиной часа сверления сильно нагрелась и начала закипать.
Данным экспериментом граф Румфорд первым доказал взаимосвязь меж механической работой и внутренней энергией. Он учитывал внутреннюю энергию, как итог особенного типа перемещения элементов материи. Совместно с британским химиком, агрохимиком, физиком и геологом Гемфри Дэви граф Румфорд существенно содействовал формированию кинетической теории теплоты. До Бенджамина Томпсона причины тепла отмечал российский учены Михаил Ломоносов.
Граф Румфорд сформировал основу термофизики. Он осуществил изобретение калориметра для того, чтобы устанавливать теплоту реакций горения веществ. В том числе, выдвинул предложение структуры фотометра для изучения поглощения света веществом. А также, произвел исследования процесса конвекции в газовых и жидкостных веществах.
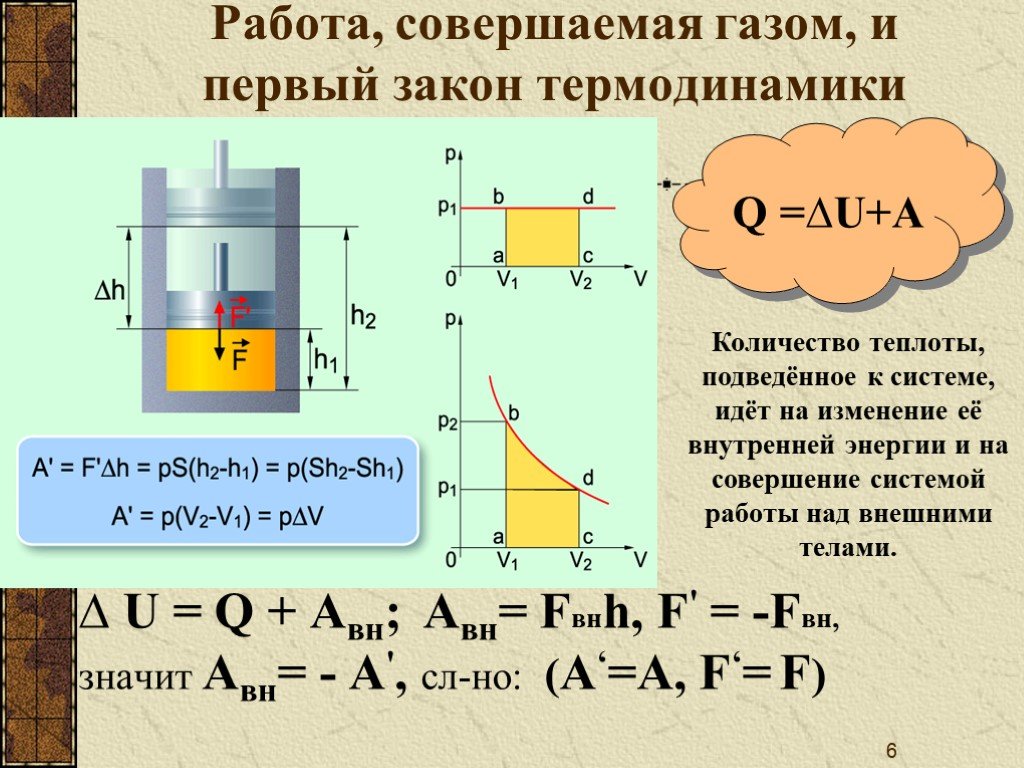
Рисунок 3. Преобразование внутренней энергии в термодинамике.
В термодинамических постоянных явлениях, если линия тела осуществляет пересечение либо кривой парового образования, либо кривую сублимации, газообразная фаза обозначается в роли пара.
Данная формулировка является традиционной, и полностью применяема к термодинамическим явлениям в простейших системах. При более комплексных структурах критическое давление составляет нижний по давлению предел сферы физических процессов. В данных процессах не существует возможности появления двухфазного состояния вещества «газ - жидкость» при любых показателях давления и напряженности.
Данное определение критического давления поясняется зачастую в физике, если требуется исследовать сферу, которая охватывает не исключительно часть газообразной фазы, а также и компоненты жидкостной фазы, располагающиеся ниже изотермы.
В том случае, когда давление данного трансформации существенно выше давления в критической точке, тогда физический объект из состояния кристаллизации переходит в газовое состояние, пропуская в процессе жидкостное состояние. Из фазовых диаграмм, используемых в термодинамике, аномального элемента не наблюдается, поскольку на данных диаграммах не указывается тот элемент структуры, где обладающие при высоких давлениях кристаллические трансформации вещества вновь обретают нормальные характеристики.
На фазовой диаграмме нормального вещества данная трансформация из твердой структуры мгновенно в газовую отражена по типу изотропного явления. Соединение молекул, которые движутся свободно и активно, в каплю жидкости при последующем сжижении газообразного вещества осуществляется только под действием сил совместного притяжения. При данном явлении кинетическая энергия касательно перемещения элементов больше энергии притяжения молекул, по данной причине, возникновение капель жидкостного вещества практически не является возможным.
Ирландский физико-химик Томас Эндрюс произвёл открытие явления непрерывности газового и жидкостного состояния вещества. Томас Эндрюс определил, что, когда производить сжимание газообразного вещества при стабильных температурных показателях и давлении, тогда напряженность вещества подлежит уменьшению. Но, с некоторого значения напряженность становиться стабильной, однако в емкости появляется жидкостное вещество. Итогом увеличения давления станет то, что газообразное вещество трансформируется в жидкостное вещество.
Томас Эндрюс экспериментально подтвердил, что, когда производить воздействие на газообразное вещество большими температурными показателями, тогда кривая зависимости первоначального давления от объема уйдет вверх, следовательно, вырастит давление концентрированного пара, а течение вещества в жидкостном состоянии будет меньше.
Соответственно, длина части изотермы, которая горизонтальна, будет опущена до нулевого значения с увеличением температурных показателей. Ученый установил, что присутствуют температурные показатели, при которых каждое физическое вещество стягивается к газу, и объемы вещества в жидкостном состоянии оказываются одинаковыми, т.е. фактически в полной мере ликвидируется отличие меж газообразным и жидкостным веществом. Данные температурные показатели в термодинамике именуются критическими.
При температурных показателях, превышающих критические, давление столь велико, что компоненты обладают возможностью существования исключительно в газовом состоянии при тепловом перемещении и большой плотности.
Не нашли то, что искали?
Попробуйте обратиться за помощью к преподавателям
По большому счету, можно произвести сжатие газообразного вещества до меньших параметров, чем у жидкостных веществ, однако при данном сжатии молекулы вещества неожиданно рассеиваются, и занимают полностью уделенный объем. По данной причине понятно почему до экспериментов Томаса Эндрюса, ученые не могли обрести в жидкостном состоянии такие компоненты, как азот, водород и кислород, при этом производя сжимание до предельно больших давлений. И это потому, что у данных веществ довольно маленькое критическое давление и температурные показатели. И для сжижения данных газов требуется их охладить до определенных температур.
Закажите подходящий материал на нашем сервисе. Разместите задание – система его автоматически разошлет в течение 59 секунд. Выберите подходящего эксперта, и он избавит вас от хлопот с учёбой.
Гарантия низких цен
Все работы выполняются без посредников, поэтому цены вас приятно удивят.
Доработки и консультации включены в стоимость
В рамках задания они бесплатны и выполняются в оговоренные сроки.
Вернем деньги за невыполненное задание
Если эксперт не справился – гарантируем 100% возврат средств.
Тех.поддержка 7 дней в неделю
Наши менеджеры работают в выходные и праздники, чтобы оперативно отвечать на ваши вопросы.
Тысячи проверенных экспертов
Мы отбираем только надёжных исполнителей – профессионалов в своей области. Все они имеют высшее образование с оценками в дипломе «хорошо» и «отлично».
Эксперт получил деньги, а работу не выполнил?
Только не у нас!
Безопасная сделка
Деньги хранятся на вашем балансе во время работы над заданием и гарантийного срока
Гарантия возврата денег
В случае, если что-то пойдет не так, мы гарантируем возврат полной уплаченой суммы
















































Заполните форму и узнайте цену на индивидуальную работу!




