






Термодинамика появилась как эмпирическая наука о ключевых методах преобразования внутренней энергии объектов для осуществления механической работы. Термин «термодинамика» предложен в 1854 году британским физиком, механиком и инженером Уильямом Томсоном, бароном Кельвином (Келвин). И со временем данный термин вытеснил первостепенное наименование данной научной дисциплины – «механическая теория теплоты».
Первые условия появления термодинамики проявились в промежутке с 1760 по 1762 годы, когда ученым из Шотландии Дж. Блэком было внедрено понятие разницы меж температурой и количеством тепла. Таким образом возникла тепловая емкость, во время опытных экспериментов по измерению теплоты плавления ледяной массы.
В противовес иным подразделам физической химии, таких как химическая кинетика и строение вещества, химическая термодинамика обладает возможностью использоваться без специализированных познаний о молекулярном построении вещества. И это запрашивает существенно меньшее число изначальной информации.
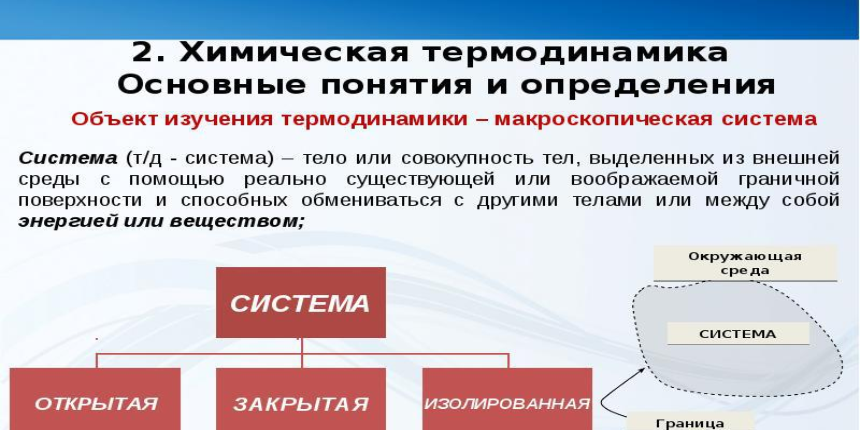
В соответствии с уровнями взаимного действия с внешней средой, системы термодинамики разделяются на:
Сложно разобраться самому?
Попробуйте обратиться за помощью к преподавателям
Для термодинамического представления системы, необходима ее структура из большого числа особых частиц. Это необходимо для совпадения с законами статистики. Характеристики системы, в то же время, разделяются на:
Совокупность характеристик системы устанавливает в последующем ее состояние. Следовательно, большинство характеристики и параметров являются взаимно связаны. Поэтому, для гомогенной однокомпонентной системы, зная количество вещества, довольно избрать для характеристики состояния два из трех.

В химических процессах одновременно действуют два противоположных фактора: энстропийный \((T∆S)\) и энтальпийный (∆H). Суммарный эффект данных противоположных факторов в процессах, протекающих при постоянном давлении и температурных показателях, определяет изменение Гиббса \((G)\): \(∆G = ∆H - T∆S.\)
Характер изменения энергии Гиббса предоставляет возможность судить о принципиальной вероятности осуществления процесса:
Состоянием равновесия в системе является постоянное во временном промежутке термодинамическое состояние системы, не обусловленное в то же время течением какого-то внешнего явления. В ситуации стабильного равновесия, все пограничные с ним состояния будут менее стабильными, а переход к ним из равновесного и стабильного состояния постоянно будет взаимно связанным с потребностью расходов работы снаружи. Всеобщими требованиями выполнения явлений равновесия считаются следующие:
Не нашли то, что искали?
Попробуйте обратиться за помощью к преподавателям
В вычислениях применяются числовые параметры (из таблицы) термодинамических показателей веществ. Даже несущественный комплект данной информации предоставляет возможность произвести вычисления большого количества различных явлений. При вычислениях равновесного состояния не нужна фиксация формул возможных химических реакций. Необходимо просто учитывать все вещества, которые способны образовывать в общем-то равновесную смесь.

Абсолютное значение энтропии возможно рассчитать, исходя из постулата Планка, являющегося третьим законом термодинамики. Энтропия индивидуального кристаллического вещества при абсолютном нуле приравнивается к нулю – \(S0 = 0.\) Для него \(W = 1,\) тогда \(S = Kln1 = 0.\) Это наиболее упорядоченная система.
Большое количество направлений химической термодинамики основывается на трех ключевых законах термодинамики. Данные законы выражены в таком виде:
Постоянно присутствует вероятность использования законов традиционной термодинамики относительно живых организмов. Открытые живые системы в конкретных периодах времени исследуются в роли квазизакрытых, в отношении явлений, для которых быстро определяются локальные равновесия.
Составы наивысшей иерархичности организовывают для более низких составов термостат, в пределах которого сами явления являются квазиравновесными. Внедрение энтропии предоставило вероятность определения особенных критериев, которые позволяют установить ориентир и глубину всех текущих химических явлений, для огромного числа элементов в равновесном состоянии.
Закажите подходящий материал на нашем сервисе. Разместите задание – система его автоматически разошлет в течение 59 секунд. Выберите подходящего эксперта, и он избавит вас от хлопот с учёбой.
Гарантия низких цен
Все работы выполняются без посредников, поэтому цены вас приятно удивят.
Доработки и консультации включены в стоимость
В рамках задания они бесплатны и выполняются в оговоренные сроки.
Вернем деньги за невыполненное задание
Если эксперт не справился – гарантируем 100% возврат средств.
Тех.поддержка 7 дней в неделю
Наши менеджеры работают в выходные и праздники, чтобы оперативно отвечать на ваши вопросы.
Тысячи проверенных экспертов
Мы отбираем только надёжных исполнителей – профессионалов в своей области. Все они имеют высшее образование с оценками в дипломе «хорошо» и «отлично».
Эксперт получил деньги, а работу не выполнил?
Только не у нас!
Безопасная сделка
Деньги хранятся на вашем балансе во время работы над заданием и гарантийного срока
Гарантия возврата денег
В случае, если что-то пойдет не так, мы гарантируем возврат полной уплаченой суммы
















































Заполните форму и узнайте цену на индивидуальную работу!




