






Преобразование тепла в тепловых механизмах в механическую работу выполняется при помощи рабочего объекта, которым обыкновенно считается газообразное вещество. Первое термодинамическое начало гласит, что теплота, которая сообщается системе, расходуется на преобразование ее внутреннего энергетического потенциала и на осуществление ею работы против внешних сил: \(Q = ∆U + A, A = p∆V.\)

При изотермическом процессе, изменения температурных показателей газообразного вещества не происходит, таким образом, не происходит и изменений внутреннего энергетического потенциала. В процессе изотермического расширения количество теплоты, которую получает газообразное вещество, превращается в работу над внешними объектами. \(Q = A.\)
При изобарном расширении, теплота газообразного вещества поглощается, и данное вещество совершает положительную работу. При изобарном сжатии, температурные показатели газообразного вещества уменьшаются, теплота отдается внешним объектам, внутренний энергетический потенциал при этом убывает.
Не нашли то, что искали?
Попробуйте обратиться за помощью к преподавателям
При изохорном процессе газообразное вещество работу не осуществляет. Тогда \(Q = ∆U,\) и теплота будет поглощаться газообразным веществом и будет увеличиваться его внутренний энергетический потенциал.
Термодинамику газообразных веществ возможно охарактеризовать явлениями, которые связаны с двумя видами газообразного вещества. Следовательно, в термодинамике присутствует идеальные и реальные газы. Более тщательное исследование данных видов газообразных веществ предоставит возможность лучшим образом воспринять их термодинамические свойства.

Молекулы реальных газообразных веществ находятся в постоянном и беспорядочном перемещении. Другими словами – данным молекулам характерна кинетическая энергия перемещения. Присутствие между молекулами гравитационных, электрических и магнитных силовых взаимных связей указывает на наличие у молекул энергетического потенциала взаимного воздействия, который зависит от пространства между ними.
В ситуации с огромными объемами и несущественным давлением, при многократном превышении промежутков между молекулами над их величинами, в том числе, когда присутствуют значительные температурные показатели, а также большая интенсивность беспорядочного перемещения молекул, осуществляется процесс их малого взаимного воздействия друг с другом.
В данном случае появляются условия, при которых реальное газообразное вещество имеет возможность с некоторой степенью приближения являться идеальным, что, равным образом, предоставляет возможность осуществлять вычисления для реальных газообразных веществ на основании определенных формул и соотношений, описанных для идеальных газообразных веществ. Это существенным образом делает проще вычисления и представления сущности, осуществляемых в газообразных веществах явлений. Данное поясняет ценность исследований термодинамических свойств газообразных веществ не исключительно со стороны теории, но и с позиции практического применения.
В роли ключевых законов для идеальных газообразных веществ в термодинамике выступают законы:
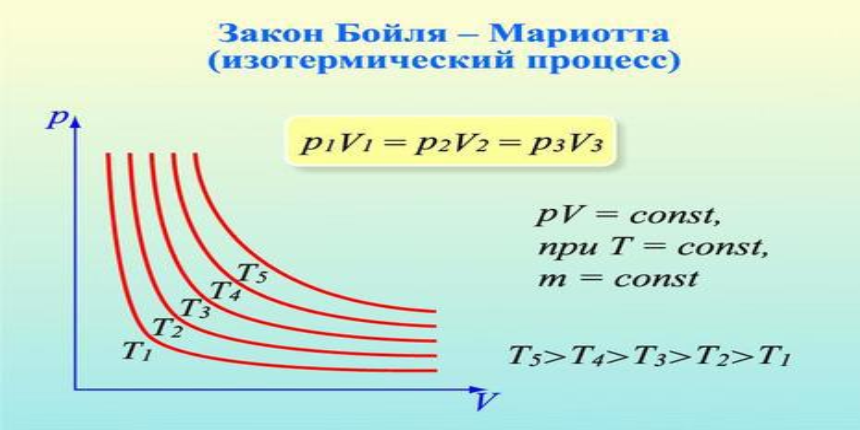
Закон Бойля-Мариотта устанавливает постоянство значения при стабильности температурных показателей. Произведение абсолютного давления газообразного вещества в изотермическом явлении на его удельный объем. Закон является верным и правильным относительно термодинамических систем с идеальным рабочим объектом, где температурные показатели являются постоянными, а переменными являются давление и объем.
Использование закона Бойля-Мариотта, благоприятствующего взаимной связи изначальных и результирующих значений давления и объема газообразного вещества, не ограничивается исключительно изотермическими явлениями. В частности, данный закон может быть верным с большой степенью вероятности и в ситуации преобразования температурных показателей при термодинамическом явлении, однако, в то же время, первоначальные и результирующие температурные показатели газообразного вещества в последствии будут однозначными.
Закон Гей-Люссака устанавливает преобразования удельного объема газа при стабильном давлении прямо пропорционально преобразованиям абсолютным температурным показателям. Данные процесс именуется изобарным. Сформулированная Гей-Люссаком закономерность считается верной в системах с одним постоянным показателем, которым является давление, а также с переменными данными удельного объема и температурных показателей. Аналогичные термодинамические явления, которые протекают при стабильном давлении, ученые именуют изобарными либо изобарическими явлениями.

Закон Шарля (второй закон Гей-Люссака) гласит об преобразованиях абсолютного давления газообразного вещества, при условиях постоянного удельного объема, прямо пропорционального преобразования абсолютных температурных показаний. Опытным экспериментом, в 1787 году, было доказано французским изобретателем и ученым Жаком Александром Сезаром Шарлем, что давление газообразного вещества от температурных показателей, при стабильном объеме. Жак Шарль занимался изучением термодинамических явлений, которые присутствуют в идеальных газообразных веществах.
Большой вклад в становление данного закон, ещё в XVII столетии сделал французский физик и механик Гийом Амонтон, а также много иных ученых, что породило проблемные вопросы определения авторства определенных термодинамических законов. И это является объектом спорных ситуаций между исследователя и по нынешнее время.
Выведенная и сформулированная исследователями закономерность считается верно и правильной в системах с постоянным удельным объемом, а также с температурными показателями, и переменным значением давления. Аналогичные термодинамические явления со стабильным удельным объемом физики именуют изохорными либо изохорическими явлениями.
В соответствии с представлением закона Авогадро, каждое газообразное вещество при условиях стабильного давления и температурных показателей в одинаковых объемах охватывают одинаковое количество молекул. Точнее сказать, закон доказывает, что объем моля различных газообразных веществ, при подобных материальных условиях является однозначным. Этот закон в 1811 году сформулировал итальянский ученый-химик, первооткрыватель фундаментального физико-химического закона Лоренцо Романо Амедео Карло Авогадро.
Сложно разобраться самому?
Попробуйте обратиться за помощью к преподавателям
Рабочий объект, применяемый в термодинамических устройствах, в стандартных ситуациях является смесью, которая сформирована из некоторого количества газообразных веществ. В роли образца возможно предоставить двигатели внутреннего сгорания. Структуру продуктов горения рабочего объекта составляют следующие вещества:
В 1801 году английский физик и химик, метеоролог, естествоиспытатель и создатель химического атомизма Джон Дальтон (Дэлтон) открыл закон, опираясь на его положения, давление, обеспечиваемое смесью, является идентичным суммированию парциальных давлений у определенных газообразных веществ, находящихся в структуре смеси. Парциальным давлением является давление элемента смеси, которое данный элемент смог бы вызывать, будучи в индивидуальном состоянии в заполняемом смесью объеме при ее конкретном температурном показателе.
Это положение с легкостью возможно доказать на базе некоторых утверждений, которые сформированы из закона Бойля-Мариотта, при исследовании парциальных элементов газа отдельно и в комплексе. Закон Дальтона является используемым по собственной актуальности для идеальных газообразных веществ. В том числе, данный закон имеет возможность применения и относительно реальных газообразных веществ, которые обладают недалекими к идеальным материальным показателям характеристикам.
Закажите подходящий материал на нашем сервисе. Разместите задание – система его автоматически разошлет в течение 59 секунд. Выберите подходящего эксперта, и он избавит вас от хлопот с учёбой.
Гарантия низких цен
Все работы выполняются без посредников, поэтому цены вас приятно удивят.
Доработки и консультации включены в стоимость
В рамках задания они бесплатны и выполняются в оговоренные сроки.
Вернем деньги за невыполненное задание
Если эксперт не справился – гарантируем 100% возврат средств.
Тех.поддержка 7 дней в неделю
Наши менеджеры работают в выходные и праздники, чтобы оперативно отвечать на ваши вопросы.
Тысячи проверенных экспертов
Мы отбираем только надёжных исполнителей – профессионалов в своей области. Все они имеют высшее образование с оценками в дипломе «хорошо» и «отлично».
Эксперт получил деньги, а работу не выполнил?
Только не у нас!
Безопасная сделка
Деньги хранятся на вашем балансе во время работы над заданием и гарантийного срока
Гарантия возврата денег
В случае, если что-то пойдет не так, мы гарантируем возврат полной уплаченой суммы
















































Заполните форму и узнайте цену на индивидуальную работу!




